白喉的病因和发病机制
該文的醫學專家
最近審查:04.07.2025
白喉是产毒素传染病的典型代表。1883年,克莱布斯(Klebs)证实白喉棒状杆菌是白喉的病原体。一年后,吕弗勒(Loeffler)发现该菌仅可在鼻咽腔中培养,并提出白喉对内脏器官的损害是由一种可溶性毒素引起的。1888年,鲁(Roux)和耶尔森(Yersin)发现,注射白喉棒状杆菌无菌滤液的动物会出现与人类白喉难以区分的器官病理;这表明一种强效外毒素是白喉的主要毒力因素。
白喉是一种最常见的上呼吸道感染,会引起发烧、咽喉痛和不适。感染部位通常会形成一层厚厚的灰绿色纤维蛋白膜,即假膜,这是细菌生长、毒素产生、潜在组织坏死以及宿主免疫反应共同作用的结果。由于认识到全身器官损害是由白喉毒素作用引起的,因此开发了有效的抗毒素疗法来治疗急性感染,并研制了高效的类毒素疫苗。
尽管类毒素免疫已使白喉在公共卫生标准要求接种疫苗的地区成为罕见疾病,但在未免疫和免疫功能低下的人群中,白喉疫情仍时有发生。相比之下,在主动免疫计划暂停的地区,白喉疫情却已达到流行病的程度。
其他类型的棒状杆菌
除了白喉杆菌、溃疡杆菌和假结核杆菌外,假白喉杆菌和干燥杆菌偶尔也会引起鼻咽和皮肤感染。后两种菌株因其产生吡嗪酰胺酶的能力而易于识别。在兽医学中,肾杆菌和库氏杆菌是重要的病原体,分别导致牛肾盂肾炎和小鼠潜伏感染。
原因
白喉的病原体白喉棒状杆菌呈细长、略弯曲的杆状,末端有棒状增厚,静止不动;不形成芽孢、荚膜或鞭毛,呈革兰氏阳性。
白喉棒状杆菌除产生毒素外,在生命过程中还产生神经氨酸酶、透明质酸酶、溶血素、坏死因子和弥漫因子等,可引起结缔组织主要物质的坏死、液化。
根据白喉棒状杆菌产生毒素的能力,可将其分为产毒白喉棒状杆菌和非产毒白喉棒状杆菌。
白喉毒素是一种强效的细菌外毒素,决定了该病的全身和局部临床表现。其产毒性由基因决定。不产毒的白喉棒状杆菌不会导致该病。
根据培养和形态学特征,所有白喉棒状杆菌可分为3个亚型:重症白喉棒状杆菌、轻症白喉棒状杆菌和中间型白喉棒状杆菌。疾病的严重程度与白喉棒状杆菌的亚型无直接关系。每个亚型都包含产毒菌株和非产毒菌株。所有亚型的产毒棒状杆菌均产生相同的毒素。[ 1 ]
结构、分类和抗原类型
白喉棒状杆菌是一种革兰氏阳性、不能运动的棒状杆菌。在组织培养或体外培养中生长的菌株,其细胞壁上含有细小的斑点,这些斑点在革兰氏染色时会导致脱色,从而产生不同的革兰氏反应。较老的培养物通常含有异染性颗粒(多偏磷酸盐),经亚甲蓝染色后会呈现蓝紫色。细胞壁糖包括阿拉伯糖、半乳糖和甘露糖。此外,还可以分离出毒性的海藻糖 6,6'-酯,其中含有等摩尔浓度的棒状菌酸和棒状菌烯酸。目前已确认三种不同的培养类型:轻型(mitis)、中间型(intermedius)和重型(gravis)。
大多数菌株生长需要烟酸和泛酸;有些菌株还需要硫胺素、生物素或庚二酸。为了获得最佳的白喉毒素产量,培养基必须补充氨基酸,并且必须静置备用。
早在1887年,Loeffler就描述了从健康个体中分离出的无毒(不产毒)白喉棒状杆菌,这些菌株与从患者体内分离出的强毒(产毒)菌株难以区分。目前已认识到,无毒白喉棒状杆菌菌株在被多种携带白喉毒素结构基因tox的不同棒状杆菌噬菌体感染并发生溶原化后,可以转变为强毒表型。无毒表型向强毒表型的溶原性转化可以在原位和体外进行。白喉毒素的结构基因对棒状杆菌噬菌体和白喉棒状杆菌均非必需。尽管存在这一观察结果,但尚未观察到白喉毒素的遗传漂变。
發病
感染的入口是口咽、鼻腔、喉部的黏膜,较少见的是眼部和生殖器的黏膜,以及破损的皮肤、伤口或烧伤表面、尿布疹、未愈合的脐带伤口。白喉棒状杆菌在入口处繁殖并分泌外毒素。
富含纤维蛋白原的渗出液在上皮细胞坏死时释放的血栓激酶的作用下渗出,并转化为纤维蛋白,形成纤维蛋白膜,这是白喉的特征性体征。
在白喉流行区,无症状鼻咽部携带者很常见。在易感人群中,产毒菌株通过在鼻咽部或皮肤病变中复制和分泌白喉毒素而致病。白喉病变通常被由纤维蛋白、细菌和炎症细胞组成的假膜覆盖。白喉毒素可被蛋白水解酶裂解成两个片段:N端片段A(催化结构域)和片段B(跨膜和受体结合结构域)。片段A催化NAD+依赖的延伸因子2的ADP核糖基化,从而抑制真核细胞的蛋白质合成。片段B与细胞表面受体结合,并促进片段A递送至细胞溶胶。
保护性免疫涉及临床疾病后对白喉毒素的抗体反应或免疫后对白喉毒素(甲醛灭活的毒素)的抗体反应。
殖民化
关于介导白喉棒状杆菌定植的因素知之甚少。然而,除了白喉毒素的产生之外,其他因素显然也会导致其毒力。流行病学研究表明,一种特定的溶菌型可以在群体中长期存在。它之后可能会被另一种溶菌型取代。一种新的溶菌型在群体中的出现及其随后的优势地位可能与其在鼻咽部生态位中定植和有效竞争的能力有关。白喉棒状杆菌可以产生神经氨酸酶,该酶将细胞表面的唾液酸裂解成丙酮酸和N-乙酰神经氨酰。脐带因子(6,6'-二-O-菌酰-α, α'-D-海藻糖)是白喉棒状杆菌的表面成分,但其在人类宿主定植中的作用尚不清楚。
白喉毒素的产生
白喉毒素的结构基因tox属于一个与棒状杆菌噬菌体密切相关的家族,其中β噬菌体的研究最为深入。白喉毒素的表达调控由铁激活的阻遏物DtxR介导,该阻遏物由白喉棒状杆菌基因组编码。毒素的表达依赖于白喉棒状杆菌的生理状态。在铁成为限制生长速率的底物的情况下,铁会从DtxR上解离,毒葛基因被激活,白喉毒素以最大速率合成并分泌到培养基中。
白喉毒素毒性极强;对于易感物种(例如人类、猴子、兔子、豚鼠),低至100至150 ng/kg体重即可致死。白喉毒素由一条535个氨基酸组成的多肽链组成。生化、遗传和X射线结构分析表明,该毒素由三个结构/功能域组成:
- N端ADP-核糖基转移酶 (催化结构域);
- 促进催化结构域穿过细胞膜的区域(跨膜结构域);
- 真核细胞受体结合结构域。
白喉毒素经温和胰蛋白酶消化并在变性条件下还原后,可在其蛋白酶敏感环处被特异性地切割成两个多肽片段(A 和 B)。片段 A 是毒素 N 端 21 kDa 的组分,包含延伸因子 2 (EF-2) 的 ADP-核糖基化催化位点。
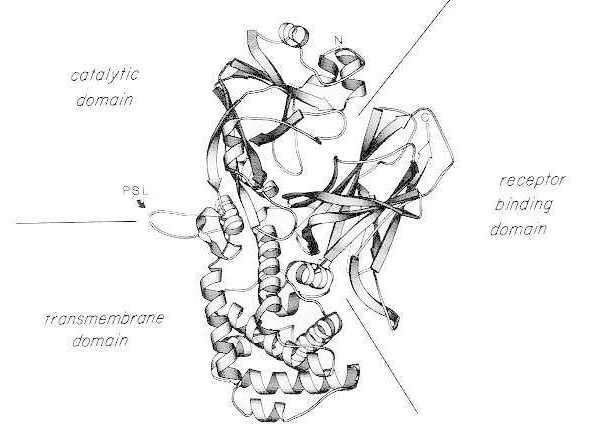
单体天然白喉毒素X射线晶体结构的带状图。(改编自Bennett MJ、Choe S、Eisenberg D: 结构域交换:蛋白质间的纠缠联盟。美国国家科学院院刊,91: 3127, 1994)。图中显示了催化结构域、跨膜结构域和受体结合结构域的相对位置。完整的毒素可被胰蛋白酶样蛋白酶在位于蛋白酶敏感环 (PSL) 中的Arg190、Arg192和/或Arg193位点处切割。Cys186和Cys201之间的二硫键还原后,毒素可分解为A和B两个片段。图中显示了完整毒素的氨基末端 (N) 和羧基末端 (C)。该带状图由MOLESCRIPT程序创建。
C 端片段,即片段 B,携带毒素的跨膜和受体结合域。
白喉毒素对单个真核细胞的中毒至少涉及四个不同的步骤:
- 毒素与细胞表面受体结合;
- 带电受体聚集到包被小窝中,并通过受体介导的内吞作用将毒素内化;随后,通过膜相关的、ATP 驱动的质子泵对内吞囊泡进行酸化,
- 将跨膜结构域插入膜中,并促进催化结构域输送到细胞溶胶中,以及
- EF-2 的 ADP 核糖基化,导致蛋白质合成不可逆的抑制。
已经证明,将催化结构域的单个分子输送到细胞溶胶中就足以杀死细胞。
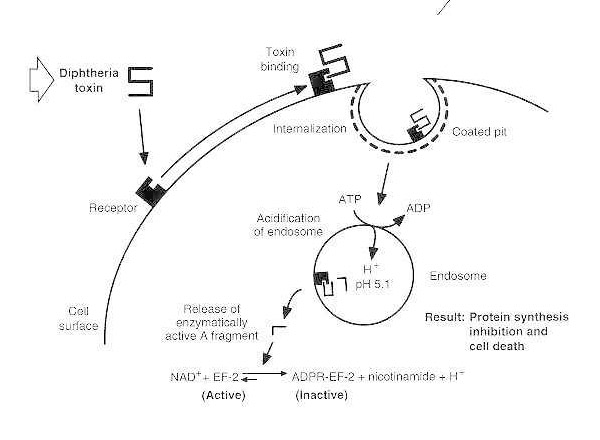
易感真核细胞白喉中毒示意图。
毒素与细胞表面受体结合,通过受体介导的内吞作用被内化;内体酸化后,跨膜结构域插入囊泡膜;催化结构域被输送到细胞溶胶,导致蛋白质合成被抑制和细胞死亡。
流行病學
在美国大规模接种白喉类毒素之前,白喉通常是一种儿童疾病。大规模接种白喉类毒素的一个显著特点是,随着抗毒素免疫保护水平(≥ 0.01 IU/mL)的人群比例增加,从人群中分离出产毒菌株的频率会下降。如今,在美国,临床白喉已几乎完全消失,分离出产毒白喉杆菌菌株的情况很少。由于亚临床感染不再是接触白喉抗原的途径,而且除非加强免疫,否则对抗毒素的免疫力会逐渐减弱,因此很大一部分成年人(30% 至 60%)的抗毒素水平低于保护水平,面临感染风险。在美国、欧洲和东欧,近期白喉疫情主要发生在酗酒和/或吸毒人群中。在这些人群中,产毒白喉杆菌携带者的抗毒素免疫力水平较高。俄罗斯公共卫生措施的崩溃导致白喉疫情蔓延。截至1994年底,俄罗斯已报告超过8万例病例,超过2000人死亡。
白喉局部疫情几乎总是与从白喉流行地区返回的免疫携带者有关。事实上,近期美国和欧洲临床白喉疫情与从俄罗斯和东欧返回的旅行者有关。产毒白喉杆菌菌株通过空气飞沫直接在人与人之间传播。已知产毒菌株可以直接在鼻咽腔内定植。此外,产毒基因还可以通过产毒棒状杆菌噬菌体的释放和不产毒的本土白喉杆菌的溶原性转化间接传播。[ 5 ]
除了对白喉杆菌分离株进行生物型和溶菌型测定外,分子生物学技术如今也可用于研究白喉疫情。限制性内切酶消化白喉杆菌染色体DNA的模式已被用于研究临床疫情,克隆的棒状杆菌插入序列也可用作基因探针。
Schick 试验多年来一直用于评估对白喉毒素的免疫力,尽管现在在许多地区它已被针对白喉毒素特异性抗体的血清学检测所取代。在 Schick 试验中,将少量白喉毒素(约 0.2 ml 中含 0.8 ng)皮内注射到前臂(测试部位),并将 0.0124 μg 白喉毒素(0.2 ml 中含 0.0124 μg)皮内注射到对照部位。分别在 48 小时和 96 小时读取读数。非特异性皮肤反应通常在 48 小时达到高峰。在 96 小时,测试部位出现红斑反应并可能伴有坏死,表明抗毒素免疫力不足以中和毒素(≤ 0.03 IU/ml)。48 小时后测试和对照区域均出现炎症,表明对抗原制剂产生了超敏反应。
形式
白喉棒状杆菌感染鼻咽部或皮肤。产毒菌株会产生一种强效外毒素,可导致白喉。白喉的症状包括咽炎、发热以及颈部或皮损周围区域肿胀。白喉病变表面覆盖一层假膜。毒素会通过血液扩散至远处器官,并可能导致瘫痪和充血性心力衰竭。[ 6 ]
临床上白喉分为两种类型:鼻咽白喉和皮肤白喉。咽白喉的症状范围从轻微的咽炎到因假膜阻塞气道而引起的缺氧。颈部淋巴结受累可能导致颈部严重肿胀(牛颈白喉),患者可能出现发热(≥ 39°C)。皮肤白喉的皮损通常被灰褐色假膜覆盖。白喉毒素作用于周围运动神经元和心肌,可能导致危及生命的全身并发症,主要是运动功能丧失(例如吞咽困难)和充血性心力衰竭。
控制
白喉的控制取决于充分的白喉类毒素免疫接种:白喉毒素经甲醛灭活,其抗原性保持完整。该类毒素的制备方法是将白喉毒素与甲醛在37°C的碱性条件下孵育。白喉免疫接种应在出生后第二个月开始,接种三剂基础疫苗,每剂间隔4至8周,并在最后一次基础疫苗接种后约1年后接种第四剂。白喉类毒素被广泛用于白喉-百日咳-破伤风(DPT)疫苗的成分。流行病学研究表明,白喉免疫接种的有效率约为97%。尽管美国和欧洲已开展大规模白喉免疫接种,且儿童免疫接种率充足,但仍有很大一部分成年人的抗体滴度可能低于保护水平。成年人应每10年重新接种一次白喉类毒素。事实上,对于前往白喉地方性流行区(中南美洲、非洲、亚洲、俄罗斯和东欧)的旅行者,应该使用白喉-破伤风类毒素进行加强免疫。近年来,使用高度纯化的类毒素制剂进行免疫已将偶发的严重超敏反应降至最低。对于前往白喉地方性流行区(中南美洲、非洲、亚洲、俄罗斯和东欧)的旅行者,应该使用白喉-破伤风类毒素进行加强免疫。近年来,使用高度纯化的类毒素制剂进行免疫已将偶发的严重超敏反应降至最低。对于前往白喉地方性流行区(中南美洲、非洲、亚洲、俄罗斯和东欧)的旅行者,应该使用白喉-破伤风类毒素进行加强免疫。近年来,使用高纯度的类毒素制剂进行免疫已最大限度地减少了偶尔发生的严重超敏反应。
虽然抗生素(例如青霉素和红霉素)是白喉患者治疗的一部分,但快速被动免疫白喉抗毒素才是降低病死率最有效的方法。特异性抗毒素在血液中的较长半衰期是确保有效中和白喉毒素的重要因素;然而,为了有效,抗毒素必须在毒素进入细胞之前与其发生反应。
白喉毒素的再设计用于开发真核受体特异性细胞毒素
蛋白质工程是分子生物学中一个新兴且发展迅速的领域;它结合重组DNA方法和固相DNA合成,设计和构建具有独特性质的嵌合基因。白喉毒素结构功能关系研究已清楚表明,该毒素是一种三结构域蛋白:催化结构域、跨膜结构域和受体结构域。目前已能够利用各种多肽激素和细胞因子(例如α-黑素细胞刺激激素[α-MSH]、白细胞介素(IL) 2、IL-4、IL-6、IL-7、表皮生长因子)通过基因工程方法取代白喉毒素的天然受体结合结构域。由此产生的嵌合蛋白或融合毒素将细胞因子的受体结合特异性与毒素的跨膜结构域和催化结构域相结合。在每种情况下,融合毒素均被证明能够选择性地毒害那些携带相应靶受体的细胞。首个此类基因改造融合毒素 DAB 389IL-2 目前正在人体临床试验中评估其用于治疗难治性淋巴瘤和自身免疫性疾病的效果,在这些疾病中,高亲和力 IL-2 受体细胞在发病机制中发挥着重要作用。[ 7 ] 研究显示,DAB 389 IL-2 的给药安全、耐受性良好,能够诱导持久的疾病缓解,且无严重副作用。基于白喉毒素的融合毒素很可能成为治疗特定肿瘤或特定细胞表面受体疾病的重要新型生物制剂。



 [
[