这项研究强调了针对特定细胞类型的艾滋病毒疗法的必要性
最近審查:02.07.2025
伊利诺伊大学的研究人员证明了针对特定细胞类型在治疗艾滋病毒(HIV)中的重要性。这项研究发表在《美国国家科学院院刊》上,是首批研究HIV潜伏期调节对髓系细胞(一种在骨髓中产生的免疫细胞)的差异性或细胞类型特异性影响的研究之一。
消除艾滋病毒感染的主要障碍之一是控制潜伏期,即受感染细胞处于休眠状态且无法产生病毒的时期。潜伏的艾滋病毒细胞会在体内聚集,形成所谓的“宿主”。潜伏宿主的问题在于,它们随时可能开始产生病毒。
要彻底根除这种疾病,需要清除体内所有潜伏细胞,或永久抵抗激活刺激。然而,多种因素均可触发再激活,包括引导髓系细胞分化的信号。
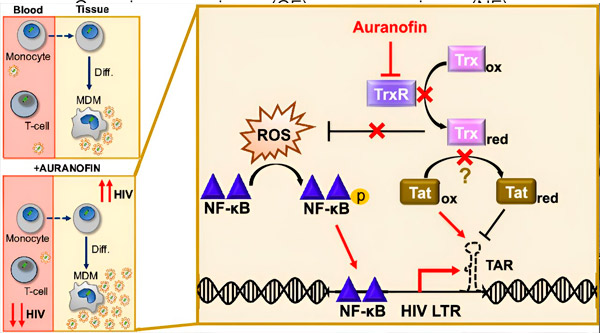
调节单核细胞衍生巨噬细胞 (MDM) 中的 HIV 潜伏期可能对病毒传播构成风险。单核细胞分化为巨噬细胞可触发 HIV 再激活,从而可能促进病毒在组织中的传播(左上)。临床候选药物金诺芬 (Auranofin) 可降低血液中的病毒 DNA,并促进 T 细胞和单核细胞中的 HIV 潜伏期,但在 MDM 中会导致 HIV 再激活(左下)。在 MDM 中,我们假设金诺芬抑制 TrxR 会导致活性氧 (ROS) 积累,从而诱导 NF-κB 活化和 HIV LTR 启动子的激活(右)。抑制 TrxR 可能会降低底物的还原,使 Tat 蛋白保持优先氧化状态,从而与 TAR 结合并启动 HIV 转录。来源:《美国国家科学院院刊》(2024)。DOI:10.1073/pnas.2313823121
多年来,HIV 治疗研究一直围绕两种方法展开,即“休克与杀伤”和“阻断与锁定”。前者与抗逆转录病毒疗法相结合,激活潜伏感染的细胞,并通过细胞凋亡(程序性细胞死亡)杀死它们;而后者则迫使受感染的细胞进入深度潜伏状态,使其无法自行重新激活。
围绕这些技术的研究传统上集中于一种名为T细胞的白细胞,它们是HIV感染的主要目标。然而,潜伏病毒库不仅仅由T细胞组成;事实上,它们包含数十种不同类型的细胞,每种细胞都有其独特的HIV基因表达模式。
“即使在同一个谱系中,细胞也存在巨大的多样性,”微生物学助理教授、论文作者科林·基弗(Collin Kieffer)说。“随着每一种新的细胞类型的出现,这些储存器的反应差异性也随之增加。”
基弗实验室的研究生亚历山德拉·布兰科(Alexandra Blanco)希望研究传统HIV研究中遗漏的细胞类型。她专注于髓系细胞,创建了一个包含70个潜伏感染单核细胞群的克隆库。布兰科随后分析了这些克隆群及其对激活的反应。这些反应差异很大,凸显了单一细胞类型内部的巨大多样性。
这一观察结果提出了一个新问题:不同类型的细胞对HIV潜伏期治疗的反应真的不同吗?事实上,他们的研究结果表明,一些HIV潜伏期疗法可以促进T细胞和单核细胞的潜伏期,同时可以逆转巨噬细胞的潜伏期。
“体内并非所有细胞都相同,”基弗说。“因此,并非所有受感染的细胞对病毒的反应都相同,这合情合理。”
他们的论文强调了未来艾滋病毒治疗需要考虑所有细胞类型以及每个细胞对潜在疗法的反应。
他们的发现以罗伊·达尔 (Roy Dar) 的研究为基础,罗伊·达尔是前伊利诺伊州生物工程教授,其实验室研究艾滋病毒基因表达的异质性。
“他开创了这个项目,我们接手并发展到今天的规模,”基弗说道。“所以,正是这次合作才真正开启了这些成果。这为我们实验室开辟了新的方向,我们对此感到非常兴奋。”
Blanco 的分析中还有一个意想不到的发现:细胞大小和形状在感染后会发生变化,这表明 HIV 可以改变细胞形态。Blanco 的下一个目标是确定这些表型变化背后的生物学机制。
基弗和他的实验室成员也期待着在原代细胞中复现他们的研究结果,这些结果大多是在细胞系中得到的。基弗解释说,在更接近人类的模型中复现这些结果将提高这项研究的临床相关性。
布兰科说:“我们希望在T细胞、单核细胞和巨噬细胞中进行更大规模的筛选,以识别可能对所有这些细胞类型都有效的潜在药物。我们甚至可能会发现更多不以细胞类型特异性方式运作的分子。”

