通过改良动物模型阐明牙周炎的细胞机制
最近審查:02.07.2025
东京医科齿科大学 (TMDU) 的研究人员开发出一种技术,可以详细分析牙周炎随时间的发展情况。
牙周病,又称牙周炎,是导致牙齿脱落的主要原因,全球近五分之一的成年人受其影响。大多数情况下,牙周病是由牙齿周围组织细菌感染引起的炎症反应引起的。
随着病情恶化,牙龈开始萎缩,牙根和牙骨暴露。值得注意的是,牙周炎的发病率随着年龄增长而增加,随着世界人口寿命的延长,深入了解其根本病因和发展过程至关重要。
在《自然通讯》杂志上发表的一项研究中,TMDU 的研究人员通过改进一种广泛用于研究牙周炎的动物模型找到了实现这一目标的方法。
直接研究人类牙周炎十分困难。因此,科学家经常利用动物模型进行临床前研究。例如,自2012年引入“结扎诱发牙周炎小鼠模型”以来,研究人员就能够研究该疾病背后的细胞机制。
简单来说,该模型通过将丝线放置在小鼠的磨牙上,导致牙菌斑堆积,从而人为地诱发牙周病。虽然这种方法方便有效,但无法全面反映牙周炎的本质。
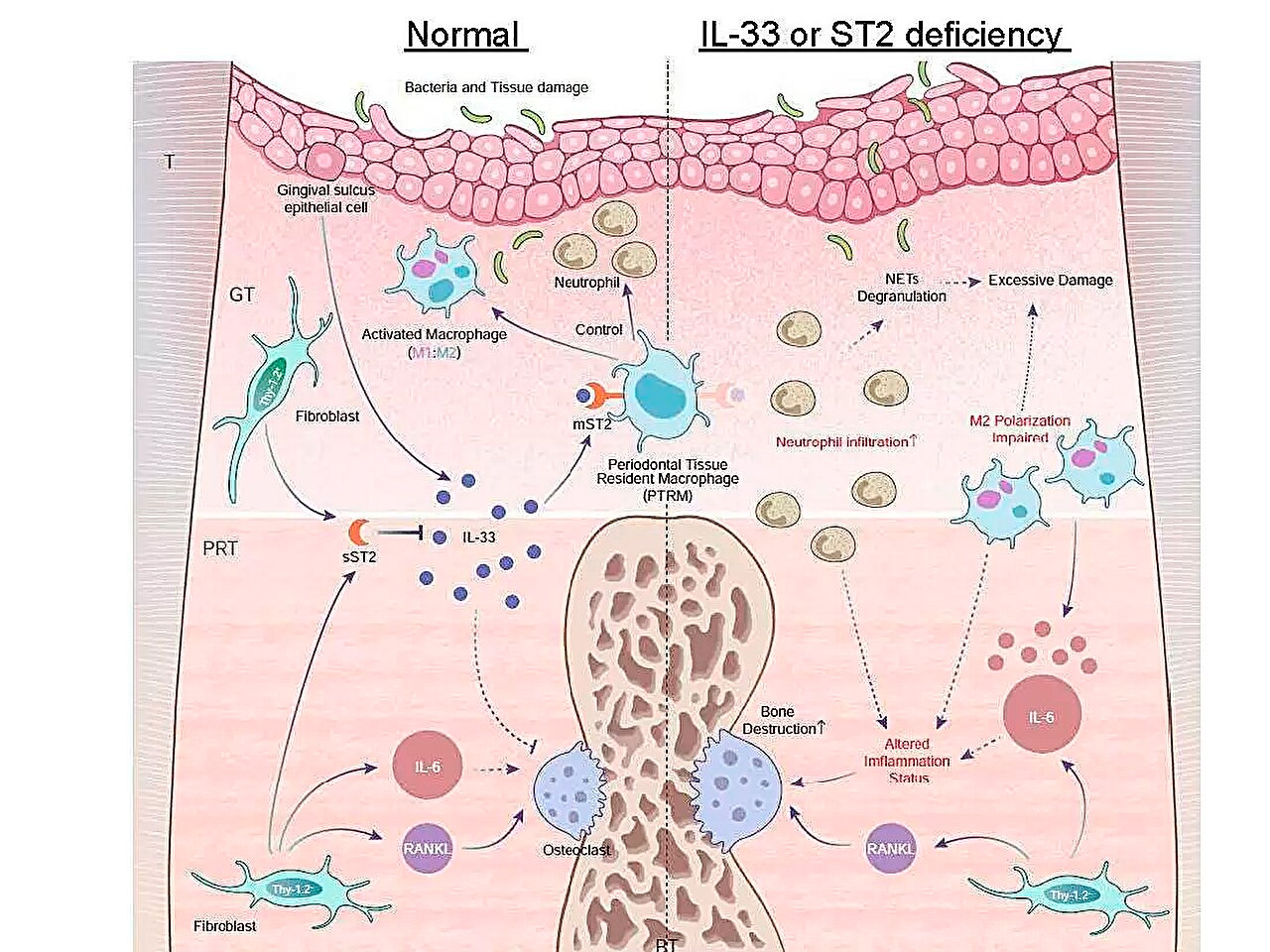
牙周炎期间炎症基因表达谱示意图,以及IL-33/ST2轴在对抗急性炎症中的作用。来源:东京医科齿科大学。
“尽管牙周组织由牙龈、牙周膜、牙槽骨和牙骨质组成,但由于技术和定量限制,分析通常仅针对牙龈样本进行,”该研究的主要作者刘安浩指出。“这种采样策略限制了从这些研究中得出的结论,因此需要能够同时分析所有组织成分的方法。”
为了解决这一局限性,研究团队开发了一种改良的结扎诱发牙周炎模型。他们没有使用经典的单根结扎线,而是在雄性小鼠的左上磨牙上使用了三根结扎线。这种策略扩大了骨质流失的面积,同时又不显著破坏第二磨牙周围的骨质,从而增加了不同类型的牙周组织的数量。
“我们分离了三种主要的组织类型,并评估了两种模型的RNA产量。结果表明,三重连接模型有效地提高了产量,获得了四倍的正常根尖周围组织量,并支持对不同组织类型的高分辨率分析,”资深作者Mikihito Hayashi博士解释道。
在确认了修改后的模型的有效性后,研究人员着手研究牙周炎对不同组织类型基因表达随时间的影响,重点关注与炎症和破骨细胞分化相关的基因。
他们的主要发现之一是,结扎五天后,根尖周围组织中Il1rl1基因的表达显著升高。该基因编码受体和诱饵异构体的ST2蛋白,该蛋白与一种名为IL-33的细胞因子结合,而IL-33参与炎症和免疫调节过程。
为了进一步了解该基因的作用,研究小组在缺乏Il1rl1或Il33基因的转基因小鼠中诱发了牙周炎。这些小鼠表现出加速的炎症性骨破坏,凸显了IL-33/ST2通路的保护作用。进一步分析了含有ST2蛋白受体形式mST2的细胞,发现它们大多来自巨噬细胞。
“巨噬细胞通常根据其活化作用分为两大类:促炎细胞和抗炎细胞。我们发现表达mST2的细胞的独特之处在于它们同时表达两种巨噬细胞的一些标志物,”资深作者Takanori Iwata博士评论道。“这些细胞在炎症开始之前就存在于根尖周围组织中,因此我们将它们命名为‘牙周组织驻留巨噬细胞’。”
总之,这项研究的结果证明了改良动物模型在更详细地研究牙周炎直至生物分子水平方面的能力。
“我们提出了一种新的IL-33/ST2分子通路可能参与调节牙周病的炎症和骨破坏,以及根尖周围组织中与牙周病密切相关的特定巨噬细胞。这有望促进新的治疗策略和预防方法的开发,”资深作者中岛智树博士总结道。

