肿瘤细胞:它们是什么?
該文的醫學專家
最近審查:04.07.2025
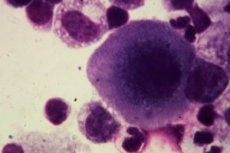
如今,许多人都在思考肿瘤细胞究竟是什么?它们的作用是什么?它们是有害的还是有益的?或者它们仅仅是为了摧毁大生物体?让我们来探讨一下这个问题。
形成恶性肿瘤的转化细胞。这些细胞会发生多种变化。这些变化在形态学、化学和生化层面上都很明显。有些变化甚至肉眼可见。其他变化则需要特殊设备才能检测。一切都取决于肿瘤的类型和位置。
其显著特征是能够无限增加其生物量,这是由于细胞凋亡(即程序性死亡)的违反造成的。这种生长只有随着人死亡才会终止。
肿瘤细胞和正常细胞的区别
细胞凋亡是一种程序性细胞死亡机制。通常情况下,完成生命周期的细胞会死亡。取而代之的是,随着时间的推移,一个新的细胞周期亚群会逐渐形成。但在癌症转化过程中,这种自然机制被破坏,导致细胞不会死亡,而是继续在体内生长和发挥作用。
正是这种内在机制,才是肿瘤形成的基本基础,具有不受控制、无限生长的趋势。也就是说,这种细胞结构本质上是一个无法死亡、无限生长的细胞。
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ]
细胞异形性和非典型细胞
非典型细胞是指易发生突变的细胞。非典型细胞通常是在各种外界因素或遗传的影响下,由干细胞转化而来。肿瘤细胞发展的诱因通常是编码细胞死亡的特定基因。一些潜在的致癌病毒,例如逆转录病毒和疱疹病毒,能够导致干细胞转化为癌细胞。
细胞异型性是健康细胞经历的实际转化过程。该过程包含一系列复杂的化学和生化过程。突变发生在免疫系统紊乱的情况下,尤其是在自身免疫性疾病中,免疫系统的功能发生改变,开始产生针对自身细胞和组织的抗体。细胞异型性的形成是由于人体自然防御能力的下降,特别是T淋巴细胞(杀伤细胞)活性受损,细胞死亡过程被破坏,导致其恶性退化。
 [ 6 ]、[ 7 ]、[ 8 ]、[ 9 ]、[ 10 ]、[ 11 ]
[ 6 ]、[ 7 ]、[ 8 ]、[ 9 ]、[ 10 ]、[ 11 ]
致癌作用
潜在组织生长的过程,与身体的正常状态无关。癌变是指正常细胞退化为肿瘤细胞的过程,肿瘤细胞虽然局部形成,但会影响全身。其特点是肿瘤可以转移,无限生长。
 [ 12 ]、[ 13 ]、[ 14 ]、[ 15 ]、[ 16 ]、[ 17 ]、[ 18 ]
[ 12 ]、[ 13 ]、[ 14 ]、[ 15 ]、[ 16 ]、[ 17 ]、[ 18 ]
显微镜下的癌细胞
癌细胞的发生发展基于细胞核的急剧增大。由于细胞核占据了大部分细胞质,因此在显微镜下很容易检测到癌细胞。有丝分裂装置也清晰可见,其破坏也很明显。首先,染色体畸变和染色体不分离的存在引起了人们的注意。这导致多核细胞的形成,细胞核增大增厚,并过渡到有丝分裂期。
显微镜下还可观察到核膜深陷。电子显微镜下可观察到核内结构(颗粒)。光学显微镜下还可观察到核轮廓的模糊。核仁可保持正常结构,并可增加数量和质量。
线粒体肿胀。同时,线粒体数量减少,线粒体结构破坏。此外,还观察到核糖体相对于内质网呈弥散排列。在某些情况下,高尔基体可能完全消失,但在某些情况下,也可能出现肥大。亚细胞结构也会发生变化,例如,溶酶体和核糖体的结构和外观发生变化。在这种情况下,细胞结构的分化程度会不均衡。
显微镜下可观察到低分化和高分化肿瘤。低分化肿瘤细胞呈苍白色,细胞器数量极少,细胞核占据大部分细胞空间,所有亚细胞结构均有不同程度的成熟和分化。高分化肿瘤的特点是保留了原有的组织结构。
肿瘤细胞的性质和特征
如果细胞发生肿瘤,其基因结构就会被破坏。这会导致抑制过程。由于其他基因的去抑制,修饰的蛋白质和同工酶会出现,从而引发细胞分裂。这会改变基因和酶的功能强度。我们经常观察到蛋白质成分的抑制。此前,这些成分负责细胞特化,并因抑制而激活。
细胞的肿瘤转化
触发病理过程的因素。有人认为化学物质直接作用于细胞的DNA和RNA。这会导致成熟过程中断,细胞通透性增强,从而使潜在的致癌病毒得以进入细胞。
一些物理因素,例如辐射水平升高、辐射和机械因素,也可能成为诱因。这些因素的影响会导致遗传物质受损、细胞周期紊乱以及基因突变。
氨基酸消耗急剧增加,合成代谢增加,分解代谢减少。糖酵解急剧增加。呼吸酶的数量也急剧减少。肿瘤细胞的抗原结构也发生了变化。特别是,它开始产生甲胎蛋白。
标记
诊断肿瘤疾病最简单的方法是进行血液检测,检测肿瘤标志物。检测过程相当快捷:2-3天即可完成,紧急情况下3-4小时即可完成。在分析过程中,可以识别出指示体内发生肿瘤过程的特定标志物。根据识别出的标志物类型,可以判断体内发生的癌症类型,甚至确定其分期。
异型性
需要注意的是,细胞不会死亡。它也可能引发病理性转移。它还具有破坏合成过程、大量吸收葡萄糖、快速分解蛋白质和碳水化合物、改变酶活性等特征。
基因组
转化性变化的本质是激活核酸合成。标准复合物会发生显著变化。负责基于天然结构合成新DNA的DNA聚合酶3的合成减少。相反,类似结构的2型DNA聚合酶的合成增加,这种酶甚至可以基于变性的DNA进行修复。这决定了所研究元素的特异性。
受体
最为人熟知的是表皮生长因子受体,它是一种跨膜受体,能够与表皮生长因子主动相互作用。
免疫表型
任何转化都会导致基因型的改变。这在表型层面的变化中得到了清晰的体现。任何此类改变对生物体来说都是外来的。这意味着人体免疫系统的过度攻击性,并伴随对生物体自身组织的攻击和破坏。
肿瘤细胞表达
这种表达有多种原因。原发性癌变仅涉及一个细胞,但有时多个细胞可能同时参与此过程。随后,肿瘤发展、生长并增殖。这一过程通常伴有自发突变。肿瘤获得了新的特性。
其显著特点是能够表达作为肿瘤生长因子的基因。这些基因会彻底改变原细胞的代谢过程,使其服从于自身的需求,就像一种寄生虫。
 [ 24 ]、[ 25 ]、[ 26 ]、[ 27 ]、[ 28 ]、[ 29 ]、[ 30 ]、[ 31 ]
[ 24 ]、[ 25 ]、[ 26 ]、[ 27 ]、[ 28 ]、[ 29 ]、[ 30 ]、[ 31 ]
弥漫性表达
对于活跃的细胞分裂,需要血液中存在抑制(抑制)基因活动的因子的持续表达。
 [ 32 ]、[ 33 ]、[ 34 ]、[ 35 ]、[ 36 ]、[ 37 ]、[ 38 ]、[ 39 ]
[ 32 ]、[ 33 ]、[ 34 ]、[ 35 ]、[ 36 ]、[ 37 ]、[ 38 ]、[ 39 ]
缺乏表达
在突变组织分化过程中,它失去了表达还原基因的能力,而这种基因负责程序性凋亡。这种能力的丧失导致相应结构失去存在的能力。因此,它能够持续生长和繁殖。
 [ 40 ]、[ 41 ]、[ 42 ]、[ 43 ]、[ 44 ]
[ 40 ]、[ 41 ]、[ 42 ]、[ 43 ]、[ 44 ]
肿瘤细胞增殖
增殖是生长的指标,决定了肿瘤的严重程度和分期。可观察到功能性间变。快速生长的肿瘤会完全丧失组织的所有原始特性。
增殖指数
该指标取决于肿瘤的定位。它由Ki-67的表达决定。它通过确定正常细胞数量与肿瘤细胞数量的比例来表示,并以百分比表示。1%为最低值,即肿瘤早期阶段。100%为最高值,通常用于诊断致命性病变。
独特性
它们是经历了突变过程的转化细胞。这些细胞还具有显著的改变原始细胞基本特性的能力。其显著特征是不会死亡,并且能够无限生长。
均匀性
首先,必须知道,这种现象只不过是人体细胞因各种原因发生了恶性转化而导致的退化。几乎所有健康的人体细胞都可能经历这一过程。关键在于存在一个触发因素,它会启动转化机制(致癌作用)。这些因素可能是病毒、细胞或组织结构的损伤,以及编码癌变的特殊基因。
循环肿瘤细胞
这种细胞的主要特征是其生化循环发生了变化。酶活性发生了变化。值得注意的是,DNA聚合酶3的数量有减少的趋势,而该酶会利用细胞原生DNA的所有成分。合成也发生了显著变化。蛋白质合成量和质量均急剧增加。尤其值得注意的是癌细胞中存在一种大核纺锤体蛋白。正常情况下,这种蛋白质的含量不应超过11%,但在肿瘤中,其含量会增加到30%。代谢活性也发生了变化。
 [ 45 ]、[ 46 ]、[ 47 ]、[ 48 ]、[ 49 ]
[ 45 ]、[ 46 ]、[ 47 ]、[ 48 ]、[ 49 ]
肿瘤干细胞
可以说,这些是原始的、未分化的结构,随后会经历功能分化。如果这样的细胞发生突变并变成癌细胞,它就会成为转移的源头,因为它可以随血流自由移动,并能够分化成任何组织。它寿命长,增殖缓慢。如果移植到免疫力低下(免疫缺陷)的人身上,可能会导致恶性肿瘤的发展。
肿瘤细胞凋亡
肿瘤细胞的主要问题是其凋亡过程(程序性死亡,即自身无法死亡,而是持续生长繁殖)被破坏。有一种基因可以抑制使细胞永生化的基因。这使得细胞能够重新启动凋亡过程,从而恢复正常的细胞活动,使细胞恢复正常状态,最终导致其死亡。
 [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ], [ 57 ]
[ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ], [ 57 ]
肿瘤细胞分化
肿瘤细胞根据其所属的组织而有所区别。肿瘤的名称也取决于其所属的组织名称以及发生肿瘤转化的器官:例如肌瘤、纤维肌瘤、上皮细胞肿瘤、结缔组织肿瘤。
Использованная литература


