研究发现蛋白质相互作用是治疗渐冻人症的潜在途径
最近審查:02.07.2025

在加拿大,得益于慈善事业,西安大略大学迈克尔·斯特朗博士领导的研究小组发现了治疗肌萎缩侧索硬化症(ALS) 的潜在方法。
这项研究阐明了蛋白质相互作用如何维持或阻止神经细胞死亡(ALS 的标志),这是 Temerty 基金会数十年研究的成果。
“作为一名医生,能够对患者或家属说‘我们正在努力阻止这种疾病’,对我来说真的很重要,”斯特朗说道。他是一位临床科学家,毕生致力于寻找ALS的治愈方法。“我们花了30年的时间才取得这一成果;30年来,我们一直心怀希望,照顾着家属、患者以及他们的亲人。这让我们有理由相信,我们已经找到了治愈方法。”
ALS,又称卢格里格氏症,是一种使人衰弱的神经退行性疾病,它会逐渐破坏负责肌肉控制的神经细胞,导致肌肉萎缩、瘫痪,最终导致死亡。确诊后,ALS 患者的平均预期寿命仅为两到五年。
在发表于《大脑》杂志的一项研究中,斯特朗团队发现,靶向受ALS影响的神经细胞中两种蛋白质之间的相互作用,可以阻止或逆转该疾病的进展。该团队还确定了实现这一目标的机制。
“重要的是,这种相互作用可能不仅是开发ALS治疗方法的关键,也是开发其他相关神经系统疾病(例如额颞叶痴呆)治疗方法的关键,”斯特朗说道,他是西方大学舒立克医学和牙科学院ALS研究的亚瑟·J·哈德森教授。“这将改变整个治疗格局。”
在几乎所有ALS患者中,一种名为TDP-43的蛋白质负责细胞内形成异常团块,从而导致细胞死亡。近年来,斯特朗的团队发现了另一种名为RGNEF的蛋白质,其功能与TDP-43相反。
该团队的最新突破是鉴定出这种RGNEF蛋白中一个特定片段,名为NF242,它可以减轻这种导致ALS的蛋白质的毒性作用。研究人员发现,当这两种蛋白质相互作用时,这种导致ALS的蛋白质的毒性就会被消除,从而显著减少对神经细胞的损伤,并防止其死亡。
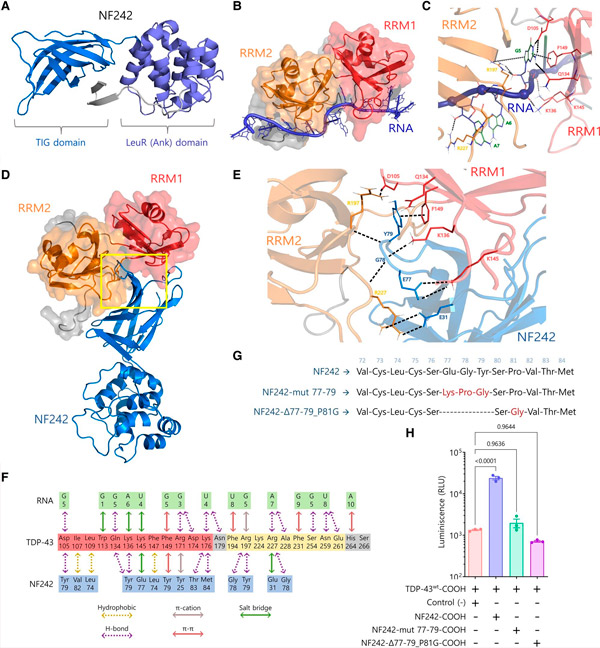
TDP-43-NF242相互作用模型。来源:Brain (2024)。DOI:10.1093/brain/awae078
在果蝇实验中,这种方法显著延长了寿命,改善了运动功能,并保护了神经细胞免于退化。同样,在小鼠模型中,这种方法也延长了寿命,增强了活动能力,并降低了神经炎症标志物。
该团队的发现之路是由 Temerty 家族对西方大学 ALS 研究的长期投资铺平的——Strong 称这种支持“真正具有变革意义”。
现在,由于 Temerty 基金会的新捐赠,Strong 和他的团队已经设定了一个目标,即在五年内将他们的潜在治疗方法投入人体临床试验。
该基金由 Northland Power Inc. 创始人詹姆斯·特默蒂 (James Temerty) 和路易斯·阿坎德·特默蒂 (Louise Arcand Temerty) 创立,将在五年内投资 1000 万美元,用于支持下一步将这种治疗方法推广给 ALS 患者。

西方大学舒立克医学与牙科学院亚瑟·J·哈德森ALS研究讲座教授迈克尔·斯特朗博士发现了一种可能治愈ALS的蛋白质。图片来源:艾伦·刘易斯/舒立克医学与牙科学院
“找到有效的ALS治疗方法对身患这种可怕疾病的患者及其亲人意义重大,”詹姆斯·特默蒂说道。“西部大学正在不断拓展ALS的认知边界,我们很高兴能为这项突破性研究的下一阶段做出贡献。”
特默蒂基金会的最新捐款使该家族对西方大学神经退行性疾病研究的总投资达到 1800 万美元。
西方大学校长艾伦·谢泼德表示:“斯特朗博士对自身事业的不懈奉献与特默蒂家族为全球成千上万被诊断患有这种毁灭性疾病的患者带来改变的强烈愿望不谋而合。特默蒂基金会的投资和远见卓识加速了ALS有效治疗方法的研发进程。我们感谢特默蒂家族对改变人生的研究的投入。”
舒立克医学和牙科学院院长 John Yu 博士表示:“这是 ALS 研究的一个转折点,有可能真正改变患者的生活。”
“感谢斯特朗博士的领导、我们对最佳工具和技术的持续投资以及 Temerty 基金会的支持,我们很高兴地宣布 ALS 患者迎来了新的希望时代。”
该研究成果在《Brain》杂志发表的一篇文章中有详细描述。

