美国食品和药物管理局批准 Bimzelx 用于治疗日光性皮炎
阿列克謝·克雷文科 ,醫學編輯
最近審查:02.07.2025
最近審查:02.07.2025
已發表: 2024-11-26 14:17
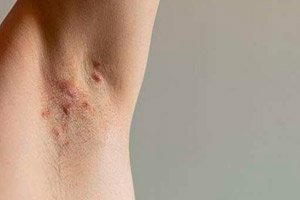
美国食品药品监督管理局(FDA)已批准UCB的Bimzelx(bimekizumab-bkzx)用于治疗中度至重度化脓性汗腺炎的成年人。
Bimzelx是首个也是唯一一个获批的除白介素17A(IL-17A)外,还选择性抑制白介素17F(IL-17F)的药物。这是Bimzelx在美国的第五个适应症。
批准依据:
该批准基于对患有中度至重度化脓性汗腺炎的成年患者进行的两项 III 期临床试验(BE HEARD I 和 BE HEARD II)的数据。
关键绩效指标:
- HiSCR50:第 16 周,与安慰剂相比,接受 Bimzelx 治疗的患者中,有显著更大比例的患者化脓性汗腺炎的体征和症状得到改善≥50%(以化脓性汗腺炎临床反应 (HiSCR50) 评分衡量)。
次要指标:
- HiSCR75:与安慰剂相比,该药物还为在第 16 周达到≥75% 改善(HiSCR75)的患者带来了具有临床意义的改善。
结果的可持续性:
- 临床反应持续至第 48 周,未发现新的安全信号。
专家意见:
波士顿贝斯以色列女执事医疗中心的 BE HEARD 项目研究员兼皮肤科医生 Alexa B. Kimball 博士表示,
“鉴于目前尚未满足的临床需求和有限的治疗选择,Bimzelx 用于治疗中度至重度化脓性汗腺炎是一项重要的进展。”

