乙型肝炎的发病机制
該文的醫學專家
最近審查:07.07.2025
在乙肝的发病机制中,可以确定发病链中的几个主要环节:
- 引入病原体——感染;
- 固定在肝细胞上并渗透到细胞内;
- 病毒繁殖并“推出”到肝细胞表面以及血液中;
- 激活旨在消除病原体的免疫反应;
- 免疫复合物对器官和系统的损害;
- 免疫力的形成、病原体的释放、康复。
由于乙肝感染通常发生在肠外,因此可以认为感染的时刻实际上等同于病毒进入血液的时刻。一些研究人员试图区分乙肝的肠道阶段和区域阶段,但证据不足。更多理由相信病毒会随血流立即进入肝脏。
乙肝病毒对肝脏组织的趋向性是由乙肝表面抗原(HBsAg)中一种特殊受体决定的——这种受体是一种分子量为31,000 Da的多肽(P31),具有白蛋白结合活性。在人类和黑猩猩的肝脏中,肝细胞膜上也发现了类似的白蛋白带,这基本上决定了乙肝病毒对人类和黑猩猩肝脏的趋向性。
当病毒穿透肝细胞时,病毒DNA被释放,进入肝细胞核,作为核酸合成的基质,引发一系列连续的生物反应,最终组装成病毒的核衣壳。核衣壳穿过核膜进入细胞质,最终组装成Dane颗粒——完整的乙肝病毒。
然而,值得注意的是,当肝细胞被感染时,这个过程可以以两种方式进行——复制和整合。在第一种情况下,会出现急性或慢性肝炎的症状;在第二种情况下,会出现病毒携带。
病毒DNA与肝细胞之间两种相互作用的原因尚不明确。最有可能的是,反应类型是由基因决定的。
复制相互作用的结果是核心抗原结构的组装(在细胞核中)和完整病毒的组装(在细胞质中),随后完整病毒或其抗原呈现在膜上或在肝细胞膜的结构中。
人们普遍认为,病毒复制不会导致肝细胞水平的细胞损伤,因为乙肝病毒本身不具有细胞病变效应。这一观点并非无可争议,因为它基于实验数据,尽管这些数据表明乙肝病毒不具有细胞病变效应,但这些数据是在组织培养物中获得的,因此不能完全推断出人类乙肝病毒的有效性。无论如何,病毒复制阶段肝细胞是否不发生损伤仍需进一步研究。
然而,无论病毒与细胞相互作用的性质如何,肝脏都必然参与免疫病理过程。在这种情况下,肝细胞的损伤与以下事实相关:由于病毒抗原在肝细胞膜上表达并释放到自由循环中,引发了一系列连续的细胞和体液免疫反应,最终目的是清除体内的病毒。该过程完全符合针对病毒感染的免疫反应的一般模式。为了清除病原体,需要进行细胞毒性反应,这些反应由各种效应细胞介导:K细胞、T细胞、自然杀伤细胞和巨噬细胞。在这些反应过程中,受感染的肝细胞被破坏,同时释放病毒抗原(HBcAg、HBeAg、HBsAg),从而触发抗体生成系统,导致特异性抗体在血液中积聚,主要针对核心抗体——抗HBc抗体和e抗原——抗HBe抗体。因此,肝细胞从病毒中释放出来是在其死亡过程中由于细胞溶解反应而发生的。
同时,血液中积聚的特异性抗体与病毒抗原结合,形成免疫复合物,被巨噬细胞吞噬,经肾脏排出。在这种情况下,可能出现各种免疫复合物病变,如肾小球肾炎、动脉炎、关节痛、皮疹等。在特异性抗体的参与下,身体清除病原体,最终完全康复。
根据乙肝发病机制的概述,该病程中各种临床表现的多样性通常可用病毒相互作用与免疫活性细胞协同作用的特性来解释,换句话说,就是对病毒抗原存在的免疫反应强度。根据现代观念,免疫反应强度由基因决定,并与HLA一级位点的组织相容性抗原相关。
一般认为,在对病毒抗原具有充分免疫应答的情况下,急性肝炎在临床上会呈现周期性病程,并最终完全康复。在对病毒抗原的免疫应答下降的背景下,免疫介导的细胞溶解作用表现不显著,因此无法有效清除受感染的肝细胞,导致轻微的临床表现,病毒长期持续存在,并可能发展为慢性肝炎。相反,在遗传决定的强烈免疫应答和大量感染(输血)的情况下,会出现大面积的肝细胞损伤,这在临床上与重症和恶性肝炎形式相对应。
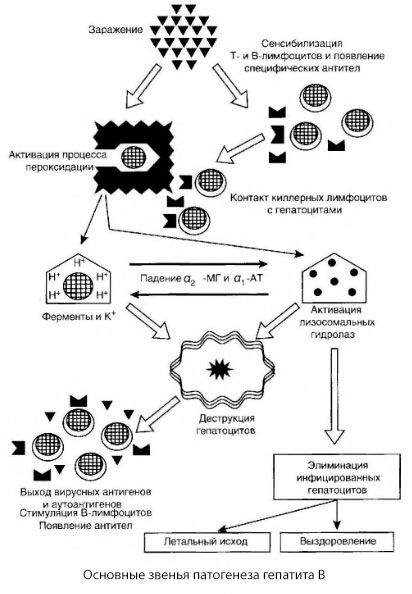
所提出的乙肝发病机制方案以其连贯性而著称;然而,它包含许多有争议且研究不足的观点。
如果我们将乙肝定义为免疫病理疾病,那么随着病情严重程度的增加,我们可以预期细胞毒性反应会增强。然而,在重症乙肝中,细胞免疫联结指数会急剧降低,与健康儿童相比,K 细胞毒性指数下降数倍。在恶性乙肝中,在大面积肝坏死,尤其是肝昏迷发展期间,淋巴细胞在植物血红蛋白、葡萄球菌内毒素和 HBsAg 的作用下完全无法进行原始细胞转化。此外,白细胞无法根据白细胞迁移抑制反应 (LMIC) 进行迁移,并且根据使用荧光四环素探针的研究结果,淋巴细胞膜的通透性急剧增加。
因此,如果健康人淋巴细胞的荧光指数为 9.9±2%,在典型的良性乙型肝炎中,该指数增至 22.3±2.7%,那么在恶性形式中,荧光淋巴细胞的数量平均达到 63.5±5.8%。由于文献中明确指出细胞膜通透性的增加是其功能低下的可靠指标,因此可以得出结论,乙型肝炎,尤其是恶性形式,淋巴细胞会受到严重损害。K 细胞毒性指数也证明了这一点。在严重形式下,疾病的第 1-2 周,细胞毒性为 15.5±8.8%,恶性形式第 1 周为 6.0±2.6,第 2 周为 22.0±6.3%,正常值为 44.8±2.6%。
所提供的数据清楚地表明,重症乙型肝炎患者的免疫细胞联系存在明显紊乱。同样明显的是,这些变化是继发性的,是由于毒性代谢物和可能的循环免疫复合物对免疫活性细胞造成损害而导致的。
研究表明,重症乙肝患者,尤其是出现大面积肝坏死的患者,血清中 HBsAg 和 HBeAg 的滴度会降低,同时开始检测到高滴度的表面抗原抗体,这与良性乙肝患者完全不同,良性乙肝患者的抗 HBV 抗体仅在发病后 3 至 5 个月才会出现。
乙肝病毒抗原的迅速消失和高滴度抗病毒抗体的同时出现提示免疫复合物的密集形成及其可能参与大面积肝坏死的发病机制。
因此,事实材料不允许我们仅从免疫病理学侵袭的角度来明确地解释乙型肝炎。问题不仅在于肝脏形态学改变的深度和普遍性与细胞免疫因素的严重程度之间没有发现任何联系。理论上,这种情况可以用细胞免疫指标研究的后期阶段来解释,当时由于肝脏功能不全的增加,免疫活性细胞受到了强大的毒性作用。当然,可以假设肝细胞的免疫细胞溶解发生在感染过程的早期阶段,甚至可能在出现严重肝损伤的临床症状之前。然而,这种假设不太可能,因为在病情最急性(闪电)的患者中检测到了类似的细胞免疫指标,此外,在肝组织形态学检查期间未检测到大量淋巴细胞浸润,同时检测到连续的坏死上皮区,没有吸收和淋巴细胞侵袭现象。
仅从免疫细胞溶解的角度很难解释急性肝炎的形态学图像,因此,在早期研究中,并未排除乙肝病毒的细胞毒作用。
目前,乙肝病毒的发现已部分证实了这一假设。研究表明,丁肝病毒标志物的检出率与疾病的严重程度直接相关:轻度患者检出率为14%,中度患者检出率为18%,重度患者检出率为30%,恶性患者检出率为52%。考虑到丁肝病毒具有致细胞坏死的作用,可以认为乙肝病毒和丁肝病毒的共同感染在暴发性乙肝的发展中具有重要意义。
乙肝的发病机制如下:乙肝病毒侵入肝细胞后,T细胞杀伤细胞会诱导对受感染肝细胞的免疫攻击,并向肝细胞方向分泌淋巴毒素。
乙肝肝细胞损伤的具体机制尚未明确。其中,脂质过氧化和溶酶体水解酶的激活过程起着主导作用。效应细胞与肝细胞接触后释放的淋巴毒素可能是其触发因素,但病毒本身也可能是过氧化过程的启动者。随后,病理过程很可能按以下顺序发展。
- 攻击因子(淋巴毒素或病毒)与生物大分子(可能与能够参与解毒过程的内质网膜成分相互作用,与其他破坏剂类似,如与四氯化碳有关)的相互作用。
- 自由基的形成、脂质过氧化过程的激活以及所有肝细胞膜通透性的增加(细胞溶解综合征)。
- 生物活性物质沿浓度梯度移动——细胞内各个定位的酶、能量供体、钾等的损失。钠和钙在细胞内积累,pH 值转向细胞内酸中毒。
- 溶酶体水解酶(RNAse、DNAse、组织蛋白酶等)的激活和释放,伴随肝细胞的分解和自身抗原的释放。
- 通过形成T淋巴细胞对肝脂蛋白的特异性致敏以及抗肝体液自身抗体来刺激T和B免疫系统。
在提出的乙肝发病机制方案中,触发因素是病毒抗原,其大量产生在疾病的早期阶段和整个急性期都可见到,恶性形式除外,在恶性形式中,病毒抗原的产生在大规模肝坏死发展时实际上停止,这预先决定了病毒复制的快速减少。
病毒抗原明显能够激活T细胞和B细胞免疫系统。在此过程中,T淋巴细胞亚群会发生特征性的重新分布,旨在组织充分的免疫反应,清除受感染的肝细胞,中和病毒抗原,促进伤口愈合和恢复。
当免疫活性细胞与肝细胞膜上的病毒抗原相互作用或在肝细胞内病毒繁殖期间,就会出现激活脂质过氧化过程的条件,众所周知,脂质过氧化过程控制着所有细胞和亚细胞膜的通透性。
从这个角度来看,细胞溶解综合征的发生,即细胞膜通透性增加,是病毒性肝炎的自然特征,是可以理解的。
细胞溶解综合征的最终结果可能是氧化磷酸化的完全解偶联、细胞物质的泄漏和肝实质的死亡。
然而,在绝大多数情况下,这些过程并不会发展到如此致命的程度。只有在恶性疾病中,病理过程才会以雪崩式且不可逆的方式进行,因为会出现大规模感染、明显的免疫过程、过氧化过程和溶酶体水解酶的过度激活以及自身免疫攻击现象。
在乙肝的良性病程中也观察到了相同的机制,唯一的不同之处在于,它们都实现在不同的质的层面上。与大面积肝坏死的情况不同,在乙肝的良性病程中,受感染的肝细胞数量较少,因此免疫病理细胞溶解区较小,脂质过氧化过程没有显著增强,酸性水解酶的激活仅导致有限的自溶,自身抗原的释放量不显著,因此,没有大规模的自噬,也就是说,在良性病程中,发病过程的所有阶段都在肝实质保存完好的结构组织框架内进行,并受到防御系统(抗氧化剂、抑制剂等)的抑制,因此不会产生如此大的破坏性作用。
病毒性肝炎中毒症状的病因尚未完全研究清楚。区分所谓的原发性(病毒性)中毒和继发性(交换性或代谢性)中毒的建议被认为是积极的,尽管这并不能揭示一般中毒综合征发生的内在机制。首先,肝炎病毒本身不具有毒性;其次,许多代谢物的浓度并不总是与疾病的严重程度和中毒症状的表现程度相关。此外,病毒抗原的浓度与中毒严重程度并非严格相关。相反,随着疾病严重程度的增加,即中毒程度的增加,乙肝表面抗原(HBsAg)的浓度会降低,在恶性肿瘤患者出现深度肝昏迷时,其浓度最低。同时,特异性抗病毒抗体的检测频率和滴度与疾病的严重程度直接相关。
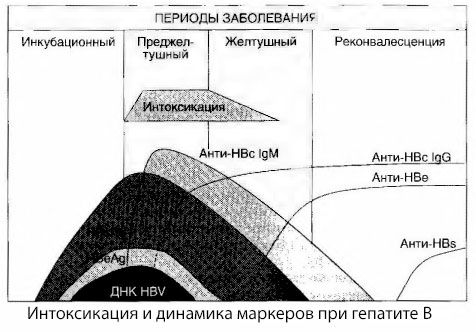
中毒并非在病毒抗原出现时出现,而是在针对牛抗原和E系统抗原的IgM类抗病毒抗体循环进入血液期间出现。此外,在严重且尤其是恶性的病例中,相当一部分患者甚至会出现血液中的抗-HBs,而这在轻度和中度病例中通常不会出现。
现有数据使我们能够得出结论:病毒性肝炎(尤其是乙型肝炎)的中毒综合征并非由血液中出现病毒抗原引起,而是病毒抗原与IgM类抗病毒抗体相互作用的结果。众所周知,这种相互作用的结果是形成免疫复合物,并可能形成活性毒性物质。
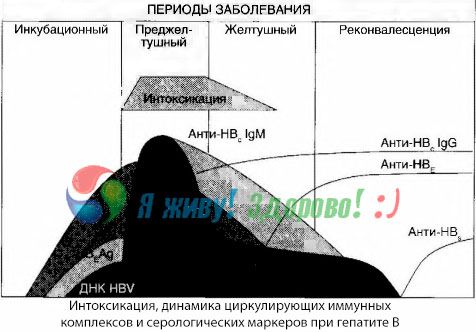
当免疫复合物在自由循环中出现时,就会出现中毒症状,但随后就不会再观察到这种相关性。
对此现象的部分解释可以在对免疫复合物组成的研究中找到。在重症患者中,血液中循环的复合物主要为中等大小,在中毒症状最严重时,其组成中以IgG类抗体为主;而在临床症状减轻和恢复期,复合物变得更大,其组成中IgG类抗体开始占主导地位。
所提供的数据涉及疾病初期中毒性综合征的发展机制,但对于临床表现高峰期发生的中毒症,它们仅具有部分意义,尤其是在肝昏迷的发展中。
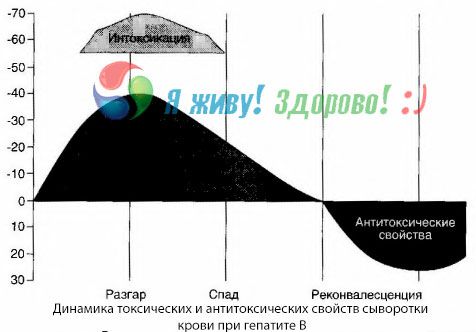
血液培养法显示,乙肝患者血液中不断积聚毒素,这些毒素由受损、腐烂的肝组织释放出来。这些毒素的浓度与病情严重程度成正比,它们是一种蛋白质。
在恢复期,血液中会出现针对此毒素的抗体;但一旦发生肝昏迷,血液中毒素浓度就会急剧升高,而血液中却检测不到抗体。
乙肝病理形态学
根据形态学变化的性质,急性乙型肝炎可分为三种类型:
- 循环形式,
- 大面积肝坏死;
- 胆汁淤积性胆管溶解性肝炎。
在乙型肝炎的周期性病变中,营养不良性、炎症性和增生性改变在肝小叶的中心部位更为明显;而在甲型肝炎中,这些改变则局限于肝小叶的周围,并向中心扩散。这些差异是由于病毒侵入肝实质的途径不同造成的。甲型肝炎病毒通过门静脉进入肝脏并扩散至肝小叶的中心部位;而乙型肝炎病毒则通过肝动脉和毛细血管分支(这些分支均匀地为所有肝小叶供血)侵入肝小叶,直至肝小叶的中心部位。
肝实质损害的程度在大多数情况下与疾病临床表现的严重程度相对应。轻度肝实质损害通常表现为肝细胞局灶性坏死,中度和重度肝实质损害表现为带状坏死(重度肝实质损害时,坏死灶有融合形成桥状坏死的趋势)。
肝实质形态学变化最显著的时期出现在临床表现的高峰期,通常与疾病的最初十年相符。在二十岁左右,尤其是三十岁左右,肝实质再生过程会加剧。此时,坏死性病变几乎完全消失,细胞浸润过程开始占据主导地位,随后肝细胞板的结构缓慢恢复。然而,肝实质结构和功能的完全恢复通常发生在发病后3-6个月,而且并非所有患者都能完全恢复。
乙肝感染的普遍性通过不仅在肝细胞中检测到 HBsAg 来证实,而且在肾脏、肺、脾脏、胰腺、骨髓细胞等中也检测到。
胆汁淤积性(胆管周围性)肝炎是该疾病的一种特殊形式,其最大的形态学改变发生在肝内胆管部分,可表现为胆管炎和胆管周围炎。在胆汁淤积型中,胆汁淤积伴随胆汁毛细血管扩张和胆汁淤积,胆管增生及其周围细胞浸润。在这种类型的肝炎中,肝细胞受到的影响很小。临床上,该疾病的特点是病程迁延,黄疸持续存在。研究表明,这种特殊病程的原因是病毒主要作用于胆管壁,而对肝细胞的影响很小。


